Para saber más sobre la estructura de la materia
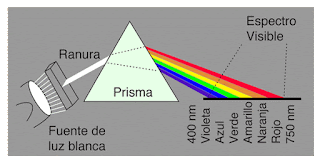
En 2º de Bachillerato estamos estudiando la estructura de la materia. Estos días hemos entendido qué son los espectros atómicos y cómo ayudaron a la evolución del modelo del átomo.
Niels Bohr combinó la nueva teoría cuántica y los estudios sobre espectros, en particular el del átomo de hidrógeno por ser el más sencillo, para proponer otro modelo con el electrón girando en órbitas circulares alrededor del núcleo, donde no todas las órbitas están permitidas. Además , la energía de las órbitas y los radios están cuantizados. Cada nivel energético viene determinado por el número cuántico principal "n".
Los saltos de electrones entre los niveles u órbitas justifican las líneas espectrales del átomo de hidrógeno.
Las diferentes líneas que aparecieron en el espectro del hidrógeno se podían agrupar en diferentes series espectrales.
En la imagen se observan las distintas zonas de la radiación electromagnética donde se producen las distintas líneas (uv, visible o infrarroja) y los niveles energéticos de partida y llegada de cada transición electrónica (salto electrónico).
El modelo atómico de Bohr no explicaba todas las líneas del espectro. Cuando se observan las líneas espectrales con aparatos de gran resolución aparecen conjuntos de líneas muy juntas, algunas de ellas se desdoblan cuando se someten a campos magnéticos. Esto sugirió la existencia de subniveles de energía. Sommerfeld modificó dicho modelo introduciendo la posibilidad de que el electrón describiese órbitas elípticas y circulares en un mismo nivel energético. La excentricidad de la órbita dio lugar al segundo número cuántico "l" , número cuántico azimutal que determina la forma de la órbita. El número de subniveles energéticos con el mismo valor de l viene dado por la fórmula 2l+1. Por ejemplo para un valor de l igual a 1 hay 2.1+1=3 subniveles, como l=1 determina el subnivel p, hay 3 subniveles p.
Imagen de las modificaciones de Sommerfeld al modelo atómico de Bohr
El efecto Zeeman, el desdoblamiento de las líneas cuando la muestra se somete a un campo magnético intenso permitió introducir el número cuántico magnético m, relacionado con la orientación de la órbita en el espacio.
Si se observa con espectrógrafos de aún mayor precisión, todas las líneas del espectro aparecen desdobladas en dos rayas. se pensó que esta aparición de dobletes podría deberse a un efecto Zeeman interno. Se supuso al electrón como una esfera cargada girando en torno a sí mismo, con dos posibles sentidos sentidos de giro que vienen representados por el número cuántico de espín "s" con valores +1/2 y -1/2.
Fuente:Serie investiga Química
Proyecto: Saber hacer








Comentarios
Publicar un comentario